Il faut 10 à 15 ans et environ 1 milliard de dollars américains pour développer un médicament efficace. Malgré ces importants investissements en temps et en argent, 90 % des candidats-médicaments dans les essais cliniques échouent.
Que ce soit parce qu’ils ne traitent pas adéquatement la condition qu’ils sont censés cibler ou parce que les effets secondaires sont trop importants, de nombreux candidats-médicaments n’atteignent jamais le stade de l’approbation.
En tant que scientifique pharmaceutique travaillant dans le développement de médicaments, j’ai été frustré par ce taux d’échec élevé. Au cours des 20 dernières années, mon laboratoire a étudié les moyens d’améliorer ce processus.
Nous pensons qu’en commençant dès les premières étapes du développement et en changeant la façon dont les chercheurs sélectionnent les candidats-médicaments potentiels, cela pourrait conduire à de meilleurs taux de réussite et, en fin de compte, à de meilleurs médicaments.
Comment fonctionne le développement de médicaments ?
Au cours des dernières décennies, le développement de médicaments a suivi ce qu’on appelle un processus classique. Les chercheurs commencent par trouver une cible moléculaire qui cause la maladie – par exemple, une protéine surproduite qui, si elle est bloquée, pourrait aider à empêcher la croissance des cellules cancéreuses.
Ils criblent ensuite une bibliothèque de composés chimiques pour trouver des candidats-médicaments potentiels qui agissent sur cette cible. Une fois qu’ils ont identifié un composé prometteur, les chercheurs l’optimisent en laboratoire.
L’optimisation des médicaments se concentre principalement sur deux aspects d’un candidat-médicament.
Premièrement, il doit être capable de bloquer fortement sa cible moléculaire sans affecter celles qui ne sont pas pertinentes. Pour optimiser la puissance et la spécificité, les chercheurs se concentrent sur sa relation structure-activité, ou sur la façon dont la structure chimique du composé détermine son activité dans le corps.
Deuxièmement, il doit être “médicamenteux”, c’est-à-dire capable d’être absorbé et transporté par le sang pour agir sur sa cible dans les organes affectés.
Une fois qu’un médicament candidat répond aux critères d’optimisation du chercheur, il passe à des tests d’efficacité et d’innocuité, d’abord sur des animaux, puis dans des essais cliniques avec des humains.
Pourquoi 90 % du développement clinique de médicaments échoue-t-il ?
Seul un candidat-médicament sur 10 passe avec succès les tests d’essais cliniques et l’approbation réglementaire. Une analyse de 2016 a identifié quatre raisons possibles pour ce faible taux de réussite.
Les chercheurs ont découvert qu’entre 40 et 50 % des échecs étaient dus à un manque d’efficacité clinique, ce qui signifie que le médicament n’était pas en mesure de produire l’effet escompté chez l’homme.
Environ 30% étaient dus à une toxicité ou à des effets secondaires ingérables, et 10 à 15% étaient dus à de mauvaises propriétés pharmacocinétiques ou à la qualité de l’absorption et de l’excrétion d’un médicament par l’organisme. Enfin, 10 % des échecs ont été attribués à un manque d’intérêt commercial et à une mauvaise planification stratégique.
Ce taux d’échec élevé soulève la question de savoir s’il existe d’autres aspects du développement de médicaments qui sont négligés. D’une part, il est difficile de vraiment confirmer si une cible moléculaire choisie est le meilleur marqueur contre lequel dépister les médicaments.
D’un autre côté, il est possible que le processus actuel d’optimisation des médicaments n’ait pas conduit à sélectionner les meilleurs candidats pour des tests supplémentaires.
(Duxin Sun et Hongxiang Hu)
Ci-dessus : à chaque étape successive du processus de développement d’un médicament, la probabilité de succès diminue de plus en plus.
Les candidats-médicaments qui parviennent aux essais cliniques doivent atteindre un équilibre délicat consistant à administrer juste assez de médicament pour qu’il ait l’effet escompté sur le corps sans causer de dommages. L’optimisation de la capacité d’un médicament à identifier et à agir fortement sur sa cible prévue est clairement importante dans sa capacité à trouver cet équilibre.
Mais mon équipe de recherche et moi pensons que cet aspect de la performance des médicaments a été surestimé. Il est tout aussi important d’optimiser la capacité d’un médicament à atteindre les parties du corps malades à des niveaux adéquats tout en évitant les parties du corps saines – son exposition tissulaire et sa sélectivité.
Par exemple, les scientifiques peuvent passer de nombreuses années à essayer d’optimiser la puissance et la spécificité des médicaments candidats afin qu’ils affectent leurs cibles à de très faibles concentrations.
Mais cela pourrait se faire au détriment de la garantie qu’une quantité suffisante de médicament atteint les bonnes parties du corps et ne cause pas de dommages aux tissus sains. Mon équipe de recherche et moi pensons que ce processus d’optimisation des médicaments déséquilibré peut fausser la sélection des candidats-médicaments et affecter leur performance finale dans les essais cliniques.
Améliorer le processus de développement de médicaments
Au cours des dernières décennies, les scientifiques ont développé et mis en œuvre de nombreux outils et stratégies d’amélioration efficaces pour chaque étape du processus de développement de médicaments.
Il s’agit notamment du dépistage à haut débit qui utilise des robots pour automatiser des millions de tests en laboratoire, accélérant ainsi le processus d’identification des candidats potentiels ; la conception de médicaments basée sur l’intelligence artificielle ; de nouvelles approches pour prédire et tester la toxicité ; et une sélection plus précise des patients dans les essais cliniques.
Malgré ces stratégies, cependant, le taux de réussite n’a toujours pas beaucoup changé.
Mon équipe et moi pensons que l’exploration de nouvelles stratégies axées sur les premières étapes du développement de médicaments lorsque les chercheurs sélectionnent des composés potentiels peut contribuer à accroître le succès.
Cela pourrait être fait avec une nouvelle technologie, comme l’outil d’édition de gènes CRISPR, qui peut confirmer plus rigoureusement la cible moléculaire correcte qui cause la maladie et si un médicament la cible réellement.
Et cela pourrait également être fait grâce à un nouveau système STAR que mon équipe de recherche et moi avons conçu pour aider les chercheurs à mieux élaborer des stratégies pour équilibrer les nombreux facteurs qui font un médicament optimal.
Notre système STAR donne à l’exposition tissulaire négligée et à l’aspect de sélectivité d’un médicament une importance égale à sa puissance et sa spécificité. Cela signifie que la capacité d’un médicament à atteindre les parties du corps malades à des niveaux adéquats sera optimisée tout autant que la précision avec laquelle il est capable d’affecter sa cible.
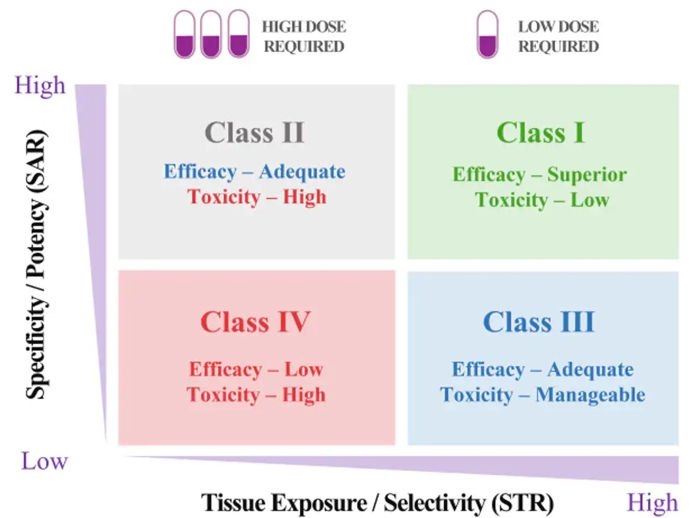
Pour ce faire, le système regroupe les médicaments en quatre classes en fonction de ces deux aspects, ainsi que des dosages recommandés. Différentes classes nécessiteraient différentes stratégies d’optimisation avant qu’un médicament ne passe à d’autres tests.
 (Duxin Sun et Hongxiang Hu)
(Duxin Sun et Hongxiang Hu)
Ci-dessus : Le système STAR offre une approche systématique de la sélection des candidats-médicaments, en tenant compte de différents facteurs qui jouent un rôle dans le succès clinique d’un médicament.
Un médicament candidat de classe I, par exemple, aurait une puissance/spécificité élevée ainsi qu’une exposition/sélectivité tissulaire élevée. Cela signifie qu’il n’aurait besoin que d’une faible dose pour maximiser son efficacité et sa sécurité et serait le candidat le plus souhaitable pour aller de l’avant.
Un candidat-médicament de classe IV, en revanche, aurait une faible puissance/spécificité ainsi qu’une faible exposition/sélectivité des tissus. Cela signifie qu’il a probablement une efficacité inadéquate et une toxicité élevée, de sorte que les tests supplémentaires doivent être interrompus.
Les candidats-médicaments de classe II ont une spécificité/puissance élevée et une faible exposition/sélectivité des tissus, ce qui nécessiterait une dose élevée pour atteindre une efficacité adéquate, mais peut avoir une toxicité ingérable. Ces candidats auraient besoin d’une évaluation plus prudente avant d’aller de l’avant.
Enfin, les candidats-médicaments de classe III ont une spécificité/puissance relativement faible, mais une exposition/sélectivité tissulaire élevée, ce qui peut nécessiter une dose faible à moyenne pour obtenir une efficacité adéquate avec une toxicité gérable. Ces candidats peuvent avoir un taux de réussite clinique élevé, mais sont souvent négligés.
Attentes réalistes pour le développement de médicaments
Faire en sorte qu’un candidat-médicament atteigne le stade des essais cliniques est un gros problème pour toute société pharmaceutique ou institution universitaire développant de nouveaux médicaments. Il est décevant de constater que les années d’efforts et de ressources consacrées à proposer un candidat-médicament aux patients se soldent si souvent par des échecs.
L’amélioration du processus d’optimisation et de sélection des médicaments peut améliorer considérablement le succès d’un candidat donné.
Bien que la nature du développement de médicaments ne permette pas d’atteindre facilement un taux de réussite de 90 %, nous pensons que même des améliorations modérées peuvent réduire considérablement le coût et le temps nécessaires pour trouver un remède à de nombreuses maladies humaines.![]()
Duxin Sun, professeur de sciences pharmaceutiques, Université du Michigan.
Cet article est republié de The Conversation sous une licence Creative Commons. Lire l’article d’origine.

